文章出處:行業(yè)干貨 網(wǎng)責(zé)任編輯: 金飛鷹 閱讀量: 發(fā)表時(shí)間:2025-04-29
越南醫(yī)療器械監(jiān)管機(jī)構(gòu)為Department of Medical Equipment and Construction(DMEC) under Ministry of Health(MoH)衛(wèi)生部所屬的醫(yī)療設(shè)備和建設(shè)部,其主要職責(zé)是:負(fù)責(zé)審核、批準(zhǔn)醫(yī)療器械的注冊(cè)和監(jiān)管,確保醫(yī)療器械在越南市場(chǎng)上符合安全性和有效性要求。
越南醫(yī)療器械注冊(cè)涉及到的主要法規(guī)有Decree No. 98/2021/ND-CPND-CP Decree on management of medical equipment《醫(yī)療器械監(jiān)管法令(2021年第98號(hào))》及Decree No.07/2023/ND-CPA mending and supplementing a number of article of Decree No. 98/2021《對(duì)2021年98號(hào)醫(yī)療器械監(jiān)管法的補(bǔ)充法令(2023年第7號(hào))》等。
越南的分類規(guī)則與馬來西亞及印尼類似,遵循 GHTF 醫(yī)療器械分類指南,根據(jù)風(fēng)險(xiǎn)由低到高,將醫(yī)療器械產(chǎn)品分為 A、B、C、D 四個(gè)等級(jí)(體外診斷試劑也一樣),越南衛(wèi)生部在2022年發(fā)布的有關(guān)醫(yī)療器械監(jiān)管法令實(shí)施細(xì)則里明確了醫(yī)療器械的16條分類規(guī)則及體外診斷醫(yī)療器械的7條分類規(guī)則。
在越南,A類和B類器械需獲得適用標(biāo)準(zhǔn)通知,C類和D類器械需獲得流通注冊(cè)證書(產(chǎn)品許可證),越南境外企業(yè)需指定當(dāng)?shù)厥跈?quán)代表進(jìn)行相關(guān)操作。
針對(duì)A類和B類器械,越南當(dāng)?shù)厥跈?quán)代表需提交Declaration of Applied Standards application(適用標(biāo)準(zhǔn)的聲明)到授權(quán)代表所在的省級(jí)衛(wèi)生局,以獲取營(yíng)銷授權(quán)碼Marketing Authorization Code(MAC)。得到批準(zhǔn)后,衛(wèi)生局將發(fā)布適用標(biāo)準(zhǔn)通知,該通知具有終身有效性。
C類和D類器械在越南進(jìn)口和銷售之前需要獲得市場(chǎng)授權(quán)(MA)許可證;當(dāng)?shù)厥跈?quán)代表需要提交上市注冊(cè)文檔Marketing Authorization Registration到衛(wèi)生部DMEC,審核和批準(zhǔn)后獲得永久有效的《流通注冊(cè)證》(產(chǎn)品許可證)。大致費(fèi)用及周期如下:
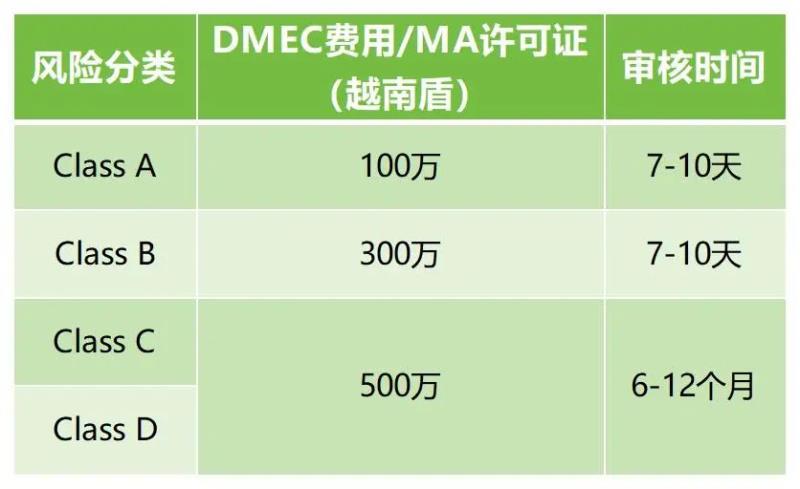
在越南申請(qǐng)醫(yī)療器械注冊(cè),是有快速審查路徑的。已獲得下列組織或國(guó)家之一的自由銷售證書或上市認(rèn)證,在越南可適用快速審查流程:
美國(guó)食品藥品監(jiān)督管理局FDA
澳大利亞藥品管理局TGA
加拿大衛(wèi)生部HC
日本厚生勞動(dòng)省MHLW或日本藥品醫(yī)療器械管理PMDA
歐盟(EU)
英國(guó)MHRA
中國(guó)國(guó)家藥品監(jiān)督管理局NMPA
韓國(guó)食品藥品安全管理部MFDS
以上就是我們本期分享的有關(guān)越南注冊(cè)相關(guān)內(nèi)容,接下來還會(huì)繼續(xù)東南亞醫(yī)療器械注冊(cè)專題分享,記得持續(xù)關(guān)注哦~假如您有東南亞注冊(cè)相關(guān)需求,歡迎隨時(shí)致電咨詢400-888-7587!
當(dāng)然,假如您有其他國(guó)內(nèi)外醫(yī)療器械注冊(cè)認(rèn)證需求,也歡迎隨時(shí)咨詢!我們的業(yè)務(wù)范圍包括但不限于:國(guó)內(nèi)外醫(yī)療器械(包含有源、無源、植入、無菌、義齒、IVD)注冊(cè)、進(jìn)口醫(yī)療器械注冊(cè)、許可備案、體系輔導(dǎo)、企業(yè)培訓(xùn)等,國(guó)內(nèi)外醫(yī)療器械注冊(cè)一站式服務(wù),請(qǐng)認(rèn)準(zhǔn)金飛鷹!
金飛鷹是國(guó)內(nèi)領(lǐng)先的醫(yī)療器械一站式注冊(cè)認(rèn)證咨詢與軟件開發(fā)管理綜合性服務(wù)集團(tuán)公司,成立于2007年。集團(tuán)總部位于深圳南山,并先后在廣州、四川、湖南、江蘇、廣西、湖北、重慶等多地設(shè)立分支機(jī)構(gòu)及辦事處。
集團(tuán)以“誠信、務(wù)實(shí)、專業(yè)、專注”的服務(wù)理念,為國(guó)內(nèi)&國(guó)外醫(yī)療器械研發(fā)者、生產(chǎn)者、經(jīng)營(yíng)者、使用者提供從產(chǎn)品立項(xiàng)、設(shè)計(jì)開發(fā)、廠房選址、廠房平面布局規(guī)劃、潔凈廠房設(shè)計(jì)規(guī)劃、企業(yè)硬件配置、設(shè)備選型、配置到人力資源組建、產(chǎn)品技術(shù)要求制定、檢驗(yàn)檢測(cè)輔導(dǎo)跟蹤、臨床評(píng)價(jià)、臨床試驗(yàn)、質(zhì)量管理體系(GMP、GSP、GB/T 42061、ISO 13485、QSR 820、MDSAP多國(guó)認(rèn)證等)建立、運(yùn)行、審核、獲證的“全方位、一站式”醫(yī)療器械產(chǎn)業(yè)專業(yè)解決方案。
金飛鷹在美容類醫(yī)療器械產(chǎn)品領(lǐng)域積累了豐富的國(guó)內(nèi)外注冊(cè)/認(rèn)證輔導(dǎo)經(jīng)驗(yàn),主要包括有源產(chǎn)品中的激光、強(qiáng)脈沖光(IPL、DPL、牛奶光)、紅藍(lán)紫光、RF射頻、超聲、中低頻電刺激及電子助推裝置類等;無源產(chǎn)品中的醫(yī)用重組型膠原蛋白、透明質(zhì)酸鈉、無針注射器、液體成膜敷料類等;服務(wù)區(qū)域包括國(guó)內(nèi)注冊(cè)/進(jìn)口注冊(cè),美國(guó)FDA、歐盟CE認(rèn)證、英國(guó)UKCA、加拿大MDL/MDEL、澳大利亞、巴西、沙特、日本、韓國(guó)、東南亞等國(guó)外注冊(cè)。,時(shí)02:07
醫(yī)療器械注冊(cè)咨詢認(rèn)準(zhǔn)金飛鷹
深圳:0755-86194173
廣州:020 - 82177679
四川:028 - 68214295
湖南:0731-22881823
湖北:181-3873-5940
江蘇:135-5494-7827
廣西:188-2288-8311
海南:135-3810-3052
重慶:135-0283-7139