? 辦理?xiàng)l件 / Conditions
根據(jù)美國(guó)聯(lián)邦法規(guī)21 CFR part 807章節(jié)的要求,涉及生產(chǎn)和分銷用于在美國(guó)進(jìn)行商業(yè)分銷的醫(yī)療器械的企業(yè)都必須每年向美國(guó)食品藥品監(jiān)督管理局(FDA)進(jìn)行注冊(cè)。注冊(cè)的過(guò)程稱之為工廠注冊(cè)(Establishment Registration);同時(shí),這些企業(yè)必須向FDA確認(rèn)他們進(jìn)行商業(yè)分銷的醫(yī)療器械,包括僅用于出口的器械,這個(gè)過(guò)程稱之為醫(yī)療器械列示(Medical Device Listing)。
自2002年2月11日起,所有的美國(guó)境外的企業(yè)必須在進(jìn)行工廠注冊(cè)時(shí)向FDA指定一個(gè)美國(guó)代理人(US AGENT)的聯(lián)系方式。
美國(guó)授權(quán)代理人:【注意:根據(jù)美國(guó)FDA法規(guī),只有美國(guó)FDA授權(quán)代理人機(jī)構(gòu)需要位于美國(guó)境內(nèi)。任何不在美國(guó)境內(nèi)的機(jī)構(gòu)或個(gè)人不能直接提供美國(guó)FDA授權(quán)代理人服務(wù)。請(qǐng)企業(yè)注意鑒別】。
目前FDA對(duì)進(jìn)入美國(guó)的產(chǎn)品要求相當(dāng)嚴(yán)格,主要包括FDA測(cè)試和FDA注冊(cè)。食品接觸材料(例如餐具、食品包裝、炊具等)、化妝品需要做FDA相應(yīng)標(biāo)準(zhǔn)的檢測(cè);食品類、醫(yī)療器械、藥品、化妝品需要做FDA注冊(cè),除化妝品為自愿注冊(cè),其他在FDA管轄范圍內(nèi)的產(chǎn)品均為強(qiáng)制性注冊(cè)。
FDA注冊(cè)企業(yè)必須提交以下信息:
(a)企業(yè)的名稱、地址、電話號(hào)碼,以及總公司(如有)的名稱、地址和電話號(hào)碼;
(b)企業(yè)的所有者、經(jīng)營(yíng)者或代理商的地址和電話號(hào)碼;
(c)企業(yè)使用的所有貿(mào)易名稱;
(d)法案170.3部分確認(rèn)的產(chǎn)品類別;
(e)證明提交信息真實(shí)準(zhǔn)確、注冊(cè)提交人已被注冊(cè)企業(yè)授權(quán)的聲明。此聲明必須有注冊(cè)該企業(yè)的提交人的姓名,還必須有注冊(cè)提交人的電話號(hào)碼、電子郵件地址(如具備)、傳真(如具備)。
(f)國(guó)外企業(yè)的美國(guó)代理人的姓名、地址、電話號(hào)碼,國(guó)外企業(yè)還需提供其美國(guó)代理人的緊急聯(lián)系電話,國(guó)內(nèi)企業(yè)也需提供緊急聯(lián)系電話。
? 辦理流程 / Processing process
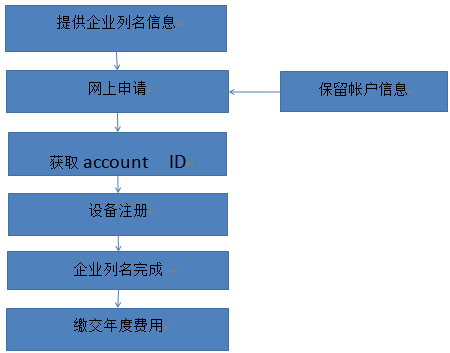
? 金飛鷹相關(guān)服務(wù) / Golden Eagle related services
●為您向FDA申請(qǐng)支付工廠注冊(cè)年費(fèi); ●FDA工廠注冊(cè)年費(fèi)支付申請(qǐng)及網(wǎng)上支付協(xié)助; ●年度費(fèi)用收取標(biāo)準(zhǔn)確認(rèn); ●為您完成工廠注冊(cè)和醫(yī)療器械列示。
服務(wù)電話 固話:0755-86194173 手機(jī):13502837139 |
| 在線客服  
| | 營(yíng)銷中心 深圳市南山區(qū)南頭街道前海路3101號(hào)-90振業(yè)國(guó)際商務(wù)中心2401 |
服務(wù)電話 固話:020-82177679/020-82176911 手機(jī):13602603195 | |  |
|
在線客服  
|
|
營(yíng)銷中心 廣州市黃埔區(qū)科學(xué)大道50號(hào)(廣州綠地中央廣場(chǎng))A3棟1906 |






















